- Dettagli
- Categoria: Scienze 2020
- Pubblicato: Mercoledì, 12 Febbraio 2020 11:22
Dimostrata per la prima volta l’efficacia della fenformina nel contrastare i tumori cerebrali pediatrici
La molecola “carica-batterie”
che spegne i tumori
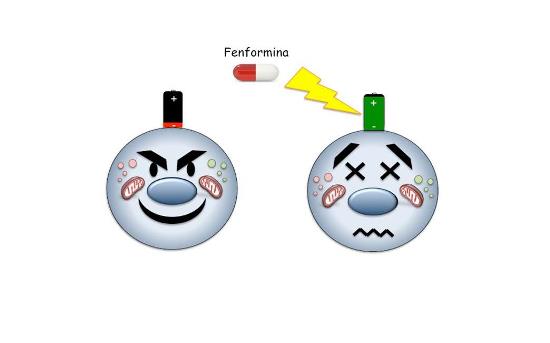
Schema di funzionamento della fenformina come carica-batterie anti-tumore (foto uniroma1.it)
12.02.20 - Scoperto il meccanismo biochimico alla base dell’azione della fenformina, la molecola che agisce su una sorta di interruttore cellulare denominato mGPD, presente nei mitocondri, attivando così un’alterazione dello stato di carica elettrica interno alla cellula tumorale. Questa alterazione elettrica, a differenza di quanto accade nelle cellule sane, determina una inibizione della crescita tumorale. Sintesi: la fenformina agisce come una batteria al contrario in quanto "carica" le cellule tumorali, per spegnerle.
Gli autori della scoperta, pubblicata sulla rivista Cell Reports, sono alcuni ricercatori dell’Università “Sapienza” di Roma, dell’Istituto Pasteur Italia e dell’IIT-Istituto Italiano di Tecnologia, coordinati da Gianluca Canettieri. Lo studio dimostra che la fenformina, un farmaco utilizzato in passato come antidiabetico insieme alla più conosciuta metformina, ha la capacità di bloccare lo stato di avanzamento del tumore.
L'obiettivo dei ricercatori è trovare una cura migliore per il medulloblastoma, il tumore maligno del cervello più comune in età pediatrica, con un’incidenza in Italia di circa 7 bambini colpiti ogni milione. Provocato da mutazioni del DNA, il medulloblastoma si forma nel cervelletto, l’area del sistema nervoso situata alla base del cervello e deputata al controllo dell’equilibrio e della coordinazione dei movimenti. La sopravvivenza a 5 anni dalla diagnosi è di poco superiore al 60% e finora non sono state identificate strategie efficaci per la prevenzione (fonte: AIRC).
Finora, nella comunità scientifica si riteneva che la fenformina agisse "soffocando" e "affamando" il tumore, ovvero agendo sui meccanismi della respirazione cellulare. Per la prima volta è stato dimostrato, invece, che il meccanismo più verosimile sembra essere quello di una “batteria al contrario”.
"Ciò che avviene nella cellula trattata con la fenformina è un processo di ossidoriduzione, ovvero un fenomeno simile a ciò che accade quando ricarichiamo le pile con il carica-batterie: aumentiamo la presenza di cariche elettriche dentro la cellula. Ma le cellule tumorali hanno delle pile che, una volta ricaricate, avviano un processo che le porta a rallentare la crescita", afferma Gianluca Canettieri, sottolineando: "Inoltre, pur avendo effettuato i nostri studi sul medulloblastoma, riteniamo che questo meccanismo di ricarica-spegnimento sia efficace anche per altri tumori, come mostrano alcuni nostri dati recenti".
Laura Di Magno, giovane ricercatrice che ha svolto il suo lavoro al Centro IIT di Roma e prima autrice del lavoro, dal canto suo commenta: "Queste osservazioni ci spingono a focalizzare i nostri studi futuri nella messa a punto di nuove strategie antitumorali basate sull’uso di farmaci o, addirittura, di specifici alimenti in grado di aumentare lo stato ossidoriduttivo cellulare, ricaricando le batterie antitumorali. Se futuri studi clinici valideranno le osservazioni pre-cliniche, la fenformina stessa potrebbe rappresentare una nuova arma efficace contro alcuni tumori, tra cui quelli cerebrali".
Si ipotizza dunque l’esistenza di cibi e integratori che siano in grado di aumentare lo stato di ossidoriduzione delle cellule, ma al momento si tratta solo di un’ipotesi in fase di approfondimento. Prosegue quindi il lavoro di ricerca del gruppo, a cui potrebbe seguire l’applicazione clinica. Fino a questo momento lo studio dell’evoluzione del tumore è stato condotto in cellule e animali di laboratorio, offrendo una prospettiva anche per l’applicazione negli esseri umani. La ricerca è stata sostenuta dalla Fondazione AIRC per la ricerca sul cancro, dall’Istituto Pasteur Italia - Fondazione Cenci Bolognetti e dall’Istituto Italiano di Tecnologia. (red)
vedi
Phenformin Inhibits Hedgehog-Dependent Tumor Growth Through a Complex I-Independent Redox/Corepressor Module - Laura Di Magno, Simona Manni, Fiorella Di Pastena, Sonia Coni, Alberto Macone, Sara Cairoli, Manolo Sambucci, Paola Infante, Marta Moretti, Marialaura Petroni, Carmine Nicoletti, Carlo Capalbo, Enrico De Smaele, Lucia Di Marcotullio, Giuseppe Giannini, Luca Battistini, Bianca Maria Goffredo, Egidio Iorio, Enzo Agostinelli, Marella Maroder and Gianluca Canettieri - Cell Reports 30, 1-18 February 11 2020 https://doi.org/10.1016/j.celrep.2020.01.024